Tip van de maand
nuttige wenken en praktische tips voor de mineralenverzamelaarvoor vragen of suggesties, email tips@minerant.org
Tip 40: microchemie deel 13: nikkel (Ni2+) aantonen
een tip van Paul Mestrom
Annabergiet, bb 5 mm, Laurion, Attika, Griekenland
Foto en collectie: Paul Mestrom
Onze aarde bestaat voor ongeveer 2,5% uit nikkel (Ni). Doordat het grootste deel daarvan niet in de buitenste korst zit, maar in de diep gelegen mantel en kern, zijn er minder dan 200 nikkelhoudende mineralen bekend! Toch kent vrijwel elke verzamelaar er daar wel een aantal van. Het meest gekend is waarschijnlijk wel annabergiet (b.v. van Laurion). Verder zijn ook nickelien, gersdorffiet, milleriet, nikkelskutterudiet en rammelsbergiet voor velen bepaald geen onbekende namen.
Genoeg reden dus om ook voor nikkel een microchemische analyse te bespreken.
Voor deze test heb je nodig:
- salpeterzuur (HNO3, 10%)
- water (uiteraard gedemineraliseerd!)
- dimethylglyoxim
- alcohol (ethanol, 96%) (bio-ethanol voldoet ook prima)
- ammoniak (NH3, 10%)
Werkwijze:
De werkwijze die ik hier geef is het resultaat van veel testen op basis van de voorschriften die ik vond in diverse boeken.
- voeg aan het fijngepoederde mineraal een druppel salpeterzuur 10% toe
- damp droog tot een wit residu
- los het residu op in een druppel demi-water
- voeg een speldenknopgrote hoeveelheid dimethylglyoxim toe
- voeg een druppel alcohol 96% toe, meng goed
- voeg een druppel ammoniak 10% toe
Indien nikkel aanwezig is, ontstaat een framboos-rood neerslag. Het resultaat van een test met een stukje annabergiet van niet meer dan 0,5 mm zie je hieronder (beeldbreedte 2 cm):

Opmerkingen:
- Eesentieel voor deze test is dat bij de voorbewerking (stap 1, de reactie met zuur) tenminste een deel het mineraal oplost. Is dat niet zo, dan betekent het uitblijven van de rode kleur dus niet dat er geen nikkel aanwezig kan zijn. Uiteraard heb ik niet alle nikkelmineralen kunnen testen, maar voor nikkelien werkte het in elk geval ook prima
- Storingen?
Demaret (Lit. 1) vermeldt bij deze test: Très délicat et tout à fait spécifique. Heel gevoelig, dus geschikt voor heel kleine hoeveelheden, en volkomen specifiek. Geen enkel ander ion vertoont deze reactie. Ijzer stoort niet, maar verbruikt wel een deel van het reagens (het dimethylglyoxim). Bij aanwezigheid van ijzer dus niet te zuinig zijn met de gebruikte hoeveelheid dimethylglyoxim.
De chemie achter deze test:
Dimethylglyoxim is een stof met de formule C4H8N2O2. De structuurformule is:
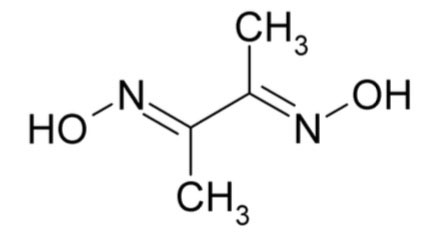
Met een aantal metaalionen kan het een complex vormen. Alleen bij nikkel is dat framboos-rood:
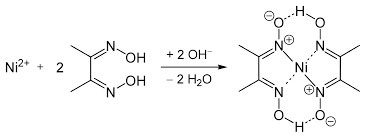
In deze vergelijking is te zien dat er base nodig is voor de vorming van het rode complex. Die base is in de beschreven werkwijze ammoniak. De rode kleur ontstaat meestal dan ook pas in stap 6.
Tot slot nog de altijd geldende opmerkingen:
- vergeet niet de nodige voorzorgsmaatregelen te nemen om verantwoord en veilig te werken!
- begin met "waardeloos" rest-materiaal
- test altijd ook met bekende mineralen om te kunnen vergelijken met de waarnemingen bij het te onderzoeken mineraal
Voor wie nog wat dieper in deze materie wil duiken:
Salpeterzuur is lastiger te verkrijgen dan zoutzuur. Bovendien is het gevaarlijker. Daarom heb ik voor annabergiet gekeken of de test ook werkt met zoutzuur.
Omdat annabergiet een arsenaat is verwachtte ik dat dat zou kunnen en dat bleek inderdaad zo te zijn, maar . . .
Toen ik de eerste versie van deze tekst naar Paul Tambuyser mailde, meldde deze me dat in "de Vogel" (lit. 3) stond dat Fe2+ met dimethylglyoxim ook een rood complex vormt. Mijn eerste gedachte daarop was: salpeterzuur is een stevige oxidator en zal Fe2+ dus wel meteen omzetten in Fe3+, zodat dat geen probleem is.
Ik besloot meteen een paar experimenten te doen met Fe(NH4)2(SO4)2 als leverancier van Fe2+ (zie foto’s onderaan).
Experiment 1:
De analyse volgens mijn voorschrift uitgevoerd met Fe(NH4)2(SO4)2.
Resultaat: een bruin-geel neerslag van Fe(OH)3 en geen roodkleuring.
Salpeterzuur schakelt het Fe2+ dus uit.
Experiment 2:
Met Fe(NH4)2(SO4)2 de procedure gevolgd vanaf punt 3 (dus zonder salpeterzuur).
Resultaat: nu wel roodkleuring.
Het Fe2+ stoort dus inderdaad.
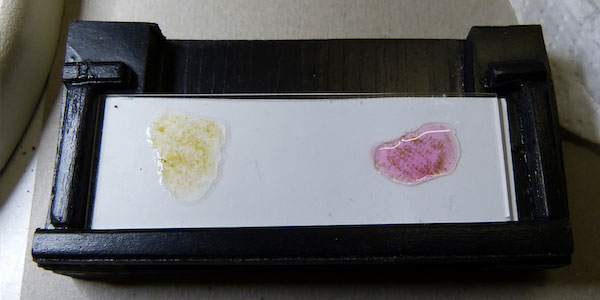
Experiment 3:
De analyse volgens mijn voorschrift uitgevoerd met Fe(NH4)2(SO4)2, maar met zoutzuur in plaats van salpeterzuur.
Resultaat: ook nu roodkleuring.
Alleen verhitten en droogdampen schakelt het Fe2+ dus niet uit.
Conclusie: altijd met salpeterzuur werken.
De resultaten van de experimenten: vlnr exp. 1, 2 en 3:

Literatuur:
1.
Demaret Cristian: Microchimie, appliquée à la détermination de minéraux par voie humide, Cercle Geologique de Hainaut, 2017
2.
Annelore Köster-Pflugmacher: Qualitative Schnellanalyse der Kationen und Anionen, Walter de Gruyter, Berlin, 1976, ISBN 3-11-004795-0
3.
Arthur I. Vogel: A text-book of macro and semimicro qualitative inorganic analysis, Longmans, London, 1965.
